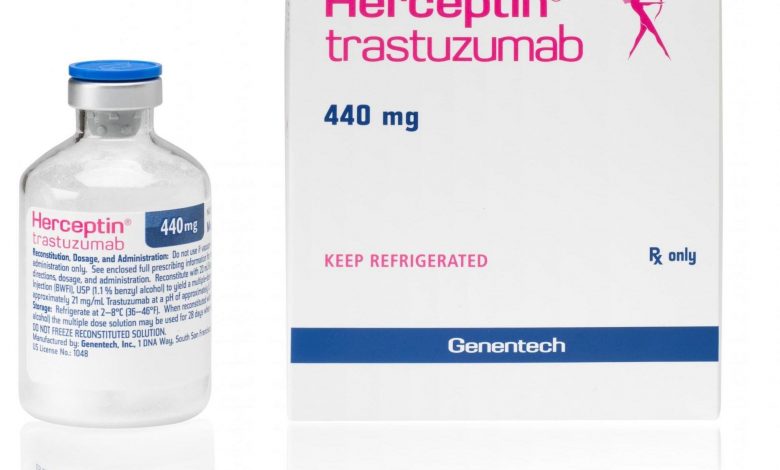
La Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS) activó una alerta sanitaria por la falsificación del producto HERCEPTIN (Trastuzumab), 440 miligramos, en solución, por irregularidades en el empaque primario.
La alerta sanitaria es publicada después de un proceso de análisis técnico realizado por personal de COFEPRIS, con base en la evidencia presentada por la empresa Productos Roche, S.A. de C.V. Detalló que el producto ostenta los números de lote N7396B 01B3129, N7396B05 B3135 y N7396, con fecha de caducidad 30 de octubre de 2022 en los tres lotes.
En tanto, la ampolleta presenta tapa desprendible con manchas e irregularidades en el contorno interno del casquillo y también se observa que en al menos uno de los lotes falta la leyenda “inyectable” en la etiqueta, además de que los textos de la vía de administración no corresponden con las leyendas autorizadas para el producto.
COFEPRIS recomienda a la población que en caso de contar y/o identificar específicamente los números de lote N7396B 01B3129, N7396B05 B3135 y N7396 del producto Herceptin, (Trastuzumab), 440 miligramos, suspender su uso y contactar con el profesional de la salud para buscar alternativas y continuar con su tratamiento médico.
Asimismo, exhorta a adquirir medicamentos solo en establecimientos formalmente constituidos que cuenten con licencia sanitaria o aviso de funcionamiento.
Al Sistema Nacional de Salud, distribuidores y farmacias recomendó que en caso de identificar los números de lote N7396B 01B3129, N7396B05 B3135 y N7396 del producto Herceptin, (Trastuzumab), 440 miligramos, no adquirirlo y en caso de tener en existencia en almacén, inmovilizarlo y contactarse con esta autoridad sanitaria y realizar la denuncia sanitaria a través de la página: https://www.gob.mx/cofepris/acciones-yprogramas/denuncias-sanitarias
Mientras que al Sistema Federal Sanitario recomendó que en caso de encontrar el medicamento referido, efectuar las acciones de protección contra riesgos sanitarios, de conformidad con lo señalado en el artículo 404 fracción X de la Ley General de Salud.
Si ha usado el producto antes referido, reportar cualquier reacción adversa o malestar causado tras el consumo de este medicamento al correo electrónico, farmacovigilancia@cofepris.gob.mx.

